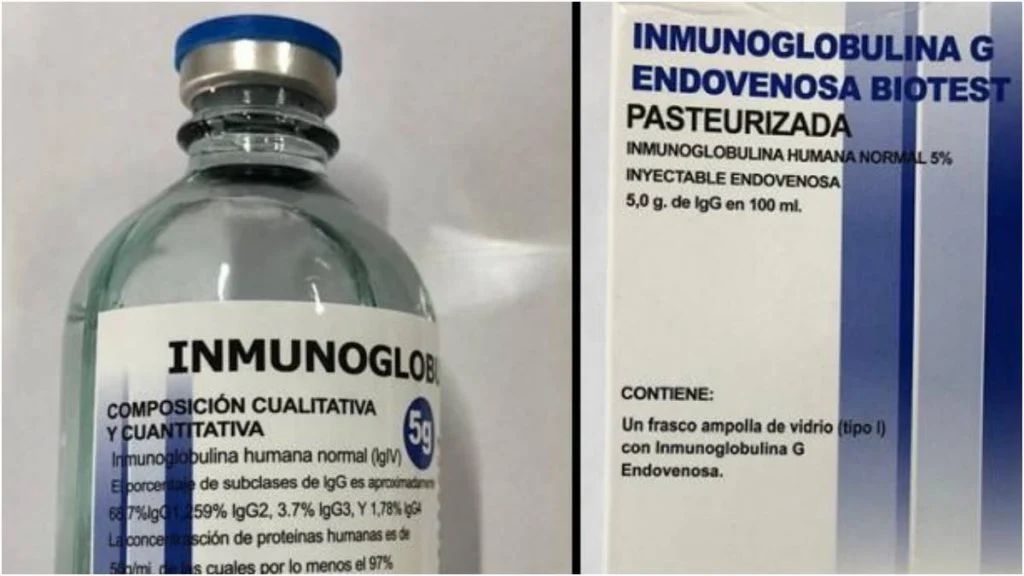
Segundo a agência, a determinação se deu por meio da Resolução RE 4.144. Lotes do produto, frasco de 100 mL de solução injetável de 50 g/L, apresentaram “resultado insatisfatório” no teste de pirogênio. Assim, havia neles substâncias que podem causar sintomas como febre, vômitos, tremor e calafrios.
Diferentes empresas importaram a imunoglobulina em questão, por meio da RDC nº 563/2021, publicada no contexto da pandemia de Covid-19 para combater o desabastecimento.
Anvisa pede interrupção do uso
A RDC previa a importação excepcional e temporária de imunoglobulina humana sem registro sanitário no Brasil, por órgãos e entidades públicas e por pessoas jurídicas de direito privado, incluindo os estabelecimentos e serviços de saúde.
De acordo com o artigo 11, os importadores são responsáveis pelo recolhimento do produto quando determinado pela Anvisa. Ou, ainda, sempre que houver indícios suficientes ou comprovação de que o produto não atende aos requisitos essenciais de qualidade, segurança e eficácia.
Dessa maneira, a Anvisa pede aos serviços de saúde que não utilizem a imunoglobulina humana da marca comercial IMMUGLO. Além disso, devem entrar em contato imediato com os fornecedores do produto para que as unidades sejam recolhidas.
Com Anvisa